生長曲線測定法和菌落計數法確定YchJ對鼠傷寒沙門菌抗逆能力的影響——方法
2方法

2.2ychJ敲除菌株構建及驗證
2.2.1ychJ敲除菌株的構建
使用表1中包含同源臂序列的引物JDychJF和JDychJR進行PCR擴增打靶區域,對PCR產物進行測序,確認gRNA打靶位點序列的正確性。將CRISPRB質粒電轉入ATCC14028s感受態細胞,將線性打靶DNA片段電轉化入ATCC14028sCRISPRB感受態細胞,選擇測序正確的克隆,將CRISPRB質粒消去,獲得敲除陽性克隆菌株ATCC14028sΔychJ.
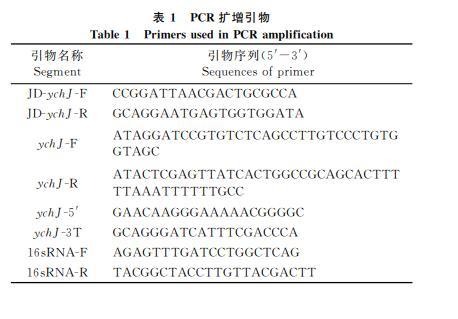
2.2.2ychJ敲除菌株的驗證將過夜培養的WT及ΔychJ按1∶100轉接于LB液體培養基中,在37℃、200r/min條件下培養至A600值約為0.5.以菌液為模板,使用表1中ychJF和ychJR為引物對兩株菌進行基因擴增驗證。其余菌液經5000r/min離心2min后棄上清,收集菌體。用RNA提取試劑盒提取細菌總RNA,然后使用反轉錄試劑盒將RNA反轉錄成cDNA.使用實時熒光定量PCR試劑盒加入ychJ基因特異引物ychJ5和ychJ3T進行實時定量PCR實驗。內參選用16sRNA.引物序列如表1.
2.3生物膜形成能力檢測
2.3.1剛果紅染色法
配制剛果紅培養基,配方為蛋白胨10mg/mL,酵母粉5mg/mL,瓊脂粉7.5mg/mL,剛果紅40μg/mL,121℃高壓滅菌30min,獲得剛果紅平板。取2μL過夜培養的菌液輕輕點在剛果紅平板上,37℃繼續培養48h,觀察細菌生物膜表型。2.3.2結晶紫半定量法將過夜培養的WT及ΔychJ菌株按1∶100轉接于LB液體培養基中,在37℃、200r/min條件下培養至A600值約為0.5,隨后再次按1∶100稀釋于LB液體培養基中。將稀釋后的菌液轉接至96孔板中,30℃靜置培養72h.測量每孔A600值后,棄去菌液。測量每孔A600值后,用PBS沖洗,加入甲醇固定20min,0.1%的結晶紫染色液,靜置染色15min,最后加入乙酸溶液,溶解結晶紫染料。在570nm下測定每孔吸光度,A570/A600與生物膜生長量成正比。
2.4抗生素耐受性檢測
2.4.1生長曲線測定法
將過夜培養的WT及ΔychJ菌株按1∶100轉接于LB液體培養基中,在37℃、200r/min條件下培養至A600值約為0.5,隨后再次按1∶100稀釋于LB液體培養基中,加入終濃度為0.5μg/mL氨芐青霉素或0.1μg/mL諾氟沙星。在96孔生長曲線測定板中加入300μL/孔的菌液,隨后將孔板放入生長曲線儀中進行A600值的測定。儀器參數設定:溫度為37℃,測定波長為600nm,振蕩頻率為10s/min,間隔檢測時間為5min,連續記錄24h.

2.4.2菌落計數法
分別取生長曲線測定實驗中培養5h(對數期)及12h(平臺期)的菌液,用PBS進行10倍稀釋,稀釋后的菌液涂布于LB瓊脂平板上,37℃靜置培養過夜,再用微生物生長曲線監測系統計數平板中細菌數目。
2.5移動性檢測
將過夜培養的WT及ΔychJ菌株按1∶100轉接于LB液體培養基中,在37℃、200r/min條件下培養至A600值約為0.5.取1mL菌液3000r/min低速離心5min,棄上清后用20μLPBS重懸,吸取1μL重懸液滴在含0.25%瓊脂的半固體培養基上,25℃培養24h,測量菌圈直徑,以確定運動能力的差異。
相關新聞推薦
2、微生物生長曲線監測系統:12種LAB發酵物對霉菌生長的抑制作用
3、耐碳青霉烯類肺炎克雷伯菌生長曲線測定及對線蟲毒力作用(二)
