呼寧散對雞肺源大腸桿菌生長曲線、細胞壁的影響及抑制效果——結果
2結果
2.1呼寧散對雞肺源大腸桿菌的抑菌效果
如表1所示,雞肺源大腸桿菌對中藥復方呼寧散為中度敏感,表明其有一定的抑菌效果。MIC和MBC結果如圖1,隨著呼寧散濃度升高,混合液的顏色逐漸變淺,當呼寧散濃度為250 mg·mL-1時,紅色沉淀完全消失,混合液變得澄清,測得呼寧散對雞肺源大腸桿菌的MIC為250 mg·mL-1,MBC為500 mg·mL-1。
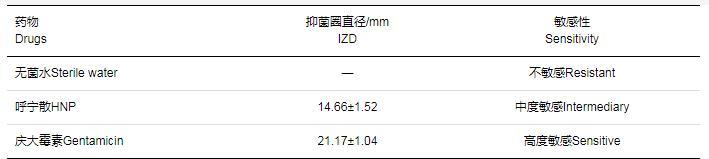
表1藥敏試驗結果(xˉ±s)

圖1呼寧散(HNP)對雞肺源大腸桿菌的MIC和MBC
2.2呼寧散對雞肺源大腸桿菌生長曲線的影響
由圖2可知,空白組的細菌生長繁殖較快,10 h之后細菌的生長達到較平穩狀態。與空白組相比,呼寧散MIC組和1/2 MIC組作用雞肺源大腸桿菌24 h內,細菌生長均受到明顯抑制(P<0.01)。結果表明,呼寧散對雞肺源大腸桿菌的生長具有明顯的抑制作用。
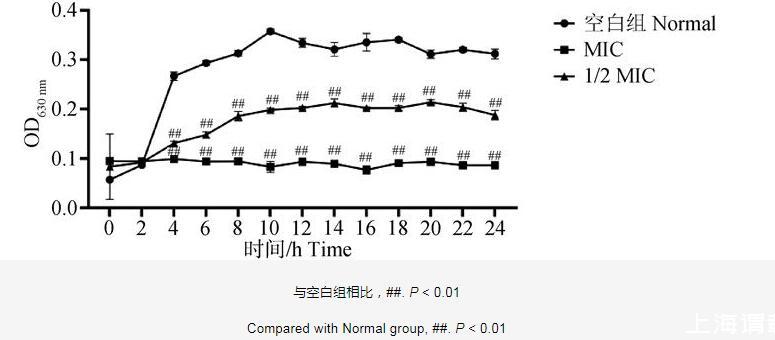
圖2雞肺源大腸桿菌的生長曲線
2.3呼寧散對雞肺源大腸桿菌細胞壁的影響
如圖3所示,與空白組相比,呼寧散作用6和12 h時,1/2 MIC組和MIC組培養液中AKP活性均極顯著升高(P<0.01),表明呼寧散能夠對雞肺源大腸桿菌的細胞壁造成破壞。

圖3雞肺源大腸桿菌中AKP活性檢測結果
2.4呼寧散對雞肺源大腸桿菌細胞膜的影響
如圖4所示,空白組菌液中的可溶性蛋白含量和核酸含量基本穩定在較低水平,無明顯波動。與空白組相比,呼寧散作用6和12 h時,1/2 MIC組和MIC組培養液中的可溶性蛋白含量和核酸含量極顯著增加(P<0.01)。表明呼寧散能夠對雞肺源大腸桿菌的細胞膜造成破壞,導致胞外蛋白濃度升高、核酸外溢。
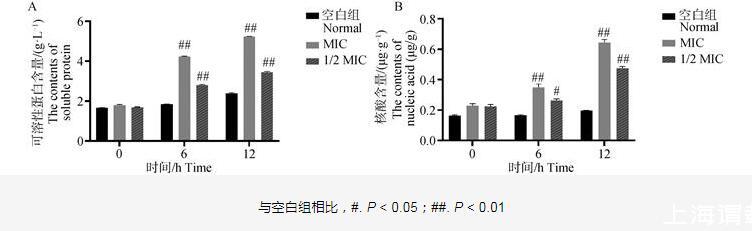
圖4雞肺源大腸桿菌中可溶性蛋白和核酸含量檢測結果
2.5 LPS對DF-1細胞的最低染毒劑量
CCK-8結果如圖5所示,當LPS濃度在40μg·mL-1時,細胞存活率顯著下降(P<0.05)。因此,本試驗選擇40μg·mL-1作為LPS誘導DF-1細胞損傷模型的染毒劑量。
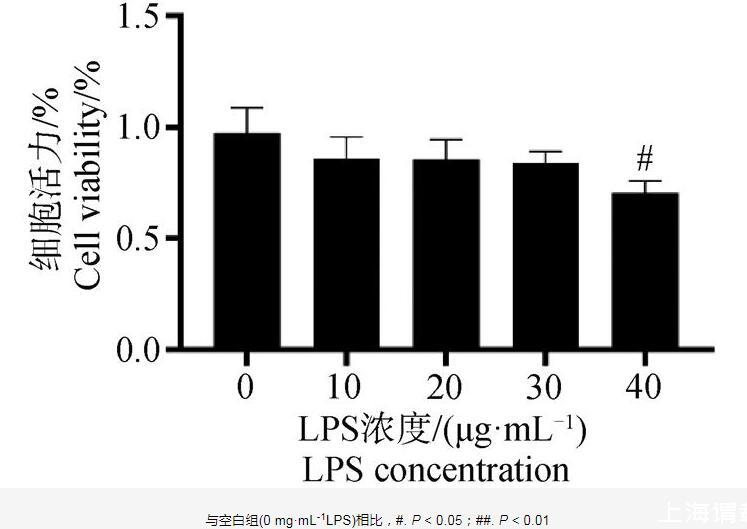
圖5 LPS對DF-1細胞活力的影響
2.6呼寧散對DF-1細胞的安全給藥濃度
CCK-8結果如圖6所示,在1.5~2.5 mg·mL-1呼寧散作用下,細胞存活率為80%~95%,且無明顯差異性,呼寧散在3 mg·mL-1濃度下細胞活力顯著降低(P<0.05),在4 mg·mL-1呼寧散作用下細胞成活率極顯著降低(P<0.01),說明呼寧散在1~2.5 mg·mL-1濃度對細胞無明顯毒性作用,因此本試驗選用1.5、2、2.5 mg·mL-1作為呼寧散低、中、高劑量組的給藥濃度。
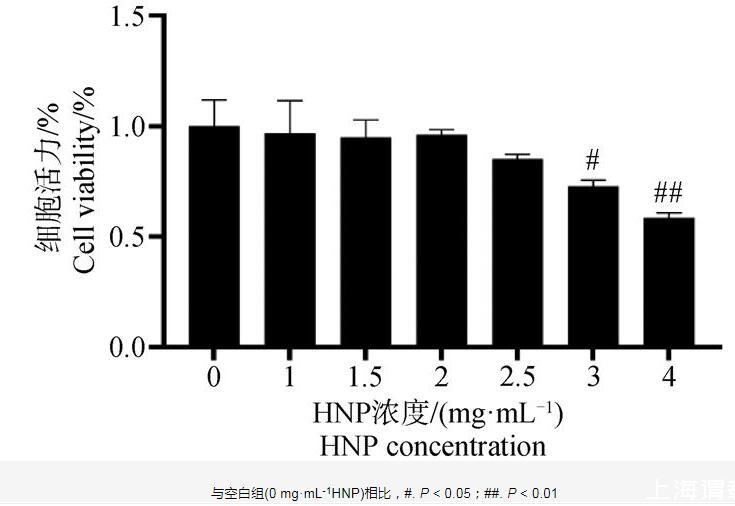
圖6呼寧散(HNP)對DF-1細胞活力的影響
2.7呼寧散對LPS致DF-1細胞炎癥因子含量的影響
收集各試驗組細胞上清液,ELISA法檢測IL-1β、IL-6、IL-8的含量。結果如表2所示,與空白組相比,LPS組中IL-1β、IL-8含量均極顯著升高(P<0.01),IL-6含量顯著升高(P<0.05)。與LPS組相比,呼寧散低劑量組IL-6、IL-8的含量降低但無顯著性差異(P>0.05),IL-1β的含量極顯著降低(P<0.01);呼寧散中劑量組IL-1β的含量極顯著降低(P<0.01),IL-6含量顯著降低(P<0.05),IL-8的含量降低但無顯著性差異(P>0.05);呼寧散高劑量組IL-1β、IL-6含量均極顯著降低(P<0.01),IL-8的含量顯著降低(P<0.05)。表明呼寧散可抑制LPS所致DF-1細胞炎癥因子IL-1β、IL-6、IL-8的過度分泌。

表2 DF-1細胞炎癥因子IL-1β、IL-6、IL-8的含量(xˉ±s)
2.8呼寧散對LPS致DF-1細胞TLR4/NF-κB炎性通路關鍵蛋白表達的影響
Western blot法測定TLR4和細胞核中NF-κB p65的表達,如圖7所示,與空白組相比,LPS組TLR4和NF-κB p65蛋白表達極顯著升高(P<0.01)。與LPS組相比,呼寧散低、中、高劑量組TLR4表達極顯著降低(P<0.01);呼寧散中劑量組NF-κB p65蛋白表達量極顯著降低(P<0.01),呼寧散低、高劑量組NF-κB p65蛋白表達量降低但無顯著性差異(P>0.05)。表明呼寧散可通過調控LPS所致DF-1細胞內炎性通路關鍵蛋白TLR4和NF-κB p65的表達,增強細胞的抗炎能力。
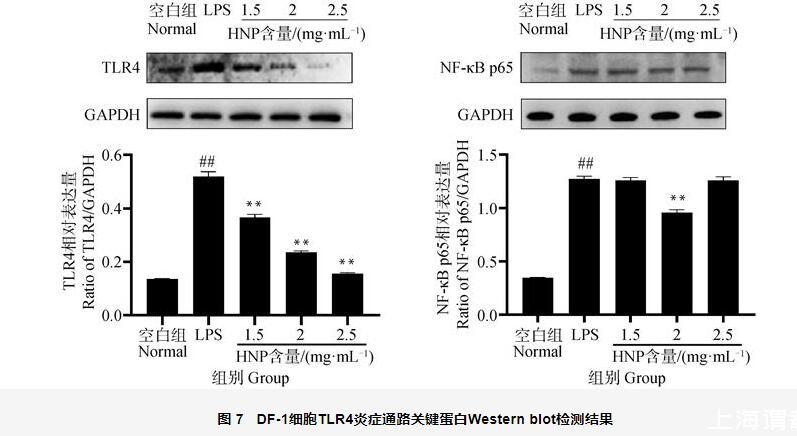
圖7 DF-1細胞TLR4炎癥通路關鍵蛋白Western blot檢測結果
2.9呼寧散對LPS致DF-1細胞氧化應激指標及抗氧化物的影響
通過試劑盒檢測各組細胞氧化應激指標ROS、MDA及抗氧化物SOD活性、GSH含量。ROS結果如圖8所示,與空白組相比,LPS組含量極顯著升高(P<0.01);與LPS組相比,呼寧散低、中、高劑量組ROS含量均極顯著降低(P<0.01)。MDA、SOD、GSH結果如表3所示,與空白組相比,LPS組MDA含量極顯著升高(P<0.01),SOD活性極顯著降低(P<0.01),GSH含量顯著降低(P<0.05)。與LPS組相比,呼寧散低劑量組MDA含量顯著降低(P<0.05),呼寧散中高劑量MDA含量極顯著下降(P<0.01);呼寧散低劑量組細胞SOD活性極顯著升高(P<0.01),GSH含量升高但無顯著性差異(P>0.05),而呼寧散中、高劑量組細胞SOD活性及GSH含量均極顯著升高(P<0.01)。結果表明,呼寧散可降低LPS損傷的DF-1細胞模型內氧化應激指標的含量并增強抗氧化物的含量,緩解LPS所致的細胞氧化損傷。
A.氧化應激指標ROS熒光顯微鏡檢測結果;B.氧化應激指標ROS平均熒光強度;a.空白組(Normal);b.LPS組;c.呼寧散低劑量組(HNP1.5);d.呼寧散中劑量組(HNP2);e.呼寧散高劑量組(HNP2.5)
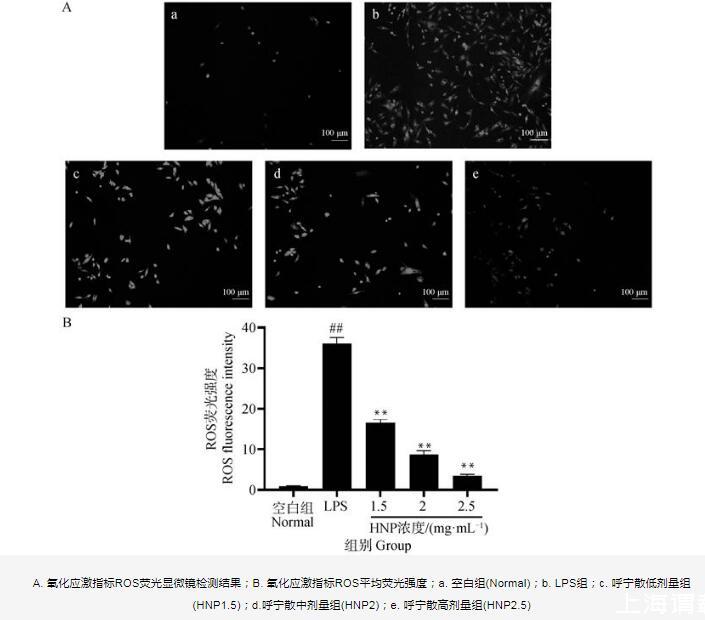
圖8 DF-1細胞內ROS水平
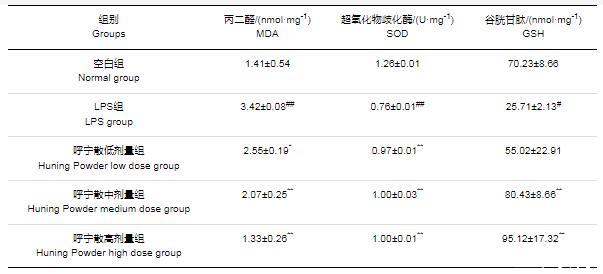
表3 DF-1細胞內MDA、SOD、GSH含量(xˉ±s)
2.10呼寧散對LPS致DF-1細胞Keap1/Nrf2氧化通路關鍵蛋白表達的影響
Western blot法測定Keap1、Nrf2、NQO1、HO-1的表達量,結果如圖9所示,與空白組相比,LPS組Keap1極顯著升高(P<0.01),Nrf2、NQO1極顯著降低(P<0.01),HO-1顯著升高(P<0.05)。與LPS組相比,呼寧散低劑量組Keap1降低但無顯著性差異(P>0.05),Nrf2、NQO1、HO-1顯著升高(P<0.05);呼寧散中、高劑量組Keap1極顯著降低(P<0.01),Nrf2、NQO1極顯著升高(P<0.01),HO-1升高但無顯著性差異(P>0.05)。結果表明,呼寧散可以通過調控LPS所致DF-1細胞內Keap1/Nrf2信號通路關鍵蛋白的表達,增強細胞的抗氧化能力。
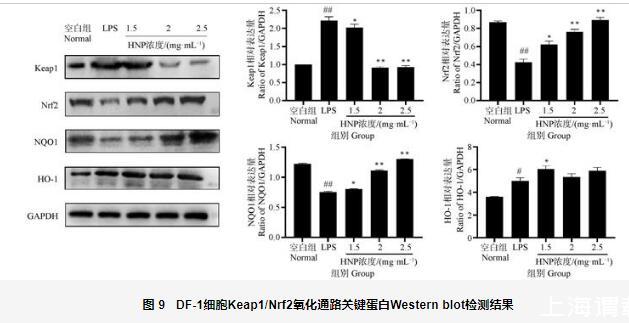
圖9 DF-1細胞Keap1/Nrf2氧化通路關鍵蛋白Western blot檢測結果
相關新聞推薦
2、藜麥和藍靛果酵母菌株篩選、培養、計數及混菌液態發酵工藝優化(二)
