微生物合成食品功能因子方法、研究策略和進展(一)
隨著社會發展和人們對安全、健康、營養飲食的追求,功能性食品的研發成為食品領域的研究熱點[1].其中,食品功能因子是功能性食品制造的基本原料,也是賦予食品特定生理功能的關鍵成分.食品功能因子種類豐富[2],根據其化學結構主要分為11類:活性多糖,功能性低聚糖和功能性單雙糖,功能性脂類,糖醇類,多糖類,氨基酸、肽與蛋白質,維生素和維生素類似物,礦物元素,植物活性成分,益生菌和低能量食品成分.這些功能因子在調節人體機能,改善睡眠和促進生長發育等方面發揮重要作用.
合成生物學作為一種更安全、更健康和綠色可持續的食品獲取方式,為功能性食品組分和重要功能營養因子的生產提供了技術支撐,成為推動食品行業發展的重要手段.以大腸桿菌(Escherichia coli,E.coli)、枯草芽孢桿菌(Bacillus subtilis,B.subtilis)、谷氨酸棒桿菌(Corynebacterium glutamicum,C.glutami cum)和釀酒酵母(Saccharomyces cerevisiae,S.cerevi siae)等為代表的典型模式微生物具有生長速度快、營養要求簡單、遺傳操作簡便和工業發酵培養模式相對成熟等優勢[3,4],已廣泛用于合成各種生物能源和生物醫藥等[5~7],同時在食品領域也被開發用于高效合成各種營養組分,如N-乙酰氨基葡萄糖[8,9]、母乳中的關鍵成分2′-巖藻糖基乳糖[10]、血紅蛋白[11]以及乳蛋白[12]等.其中,細胞的生長調控是實現高效生物制造的關鍵控制點,因此以模式微生物底盤細胞作為食品功能因子的合成載體,充分利用合成生物學原理和技術對細胞的生長進行有效精細調控,有望實現食品功能因子的高效合成.本文主要從轉運蛋白工程改造提高菌株生長速率、重編程細胞能量代謝、細胞生長與產物合成偶聯以及細胞生長與產物合成解偶聯四個方面系統總結了目前基于模式微生物生長調控合成食品功能因子的研究策略和進展(圖1),并指明微生物合成食品功能因子面臨的挑戰及未來發展方向,以期為功能因子的高效生物制造提供新思路.
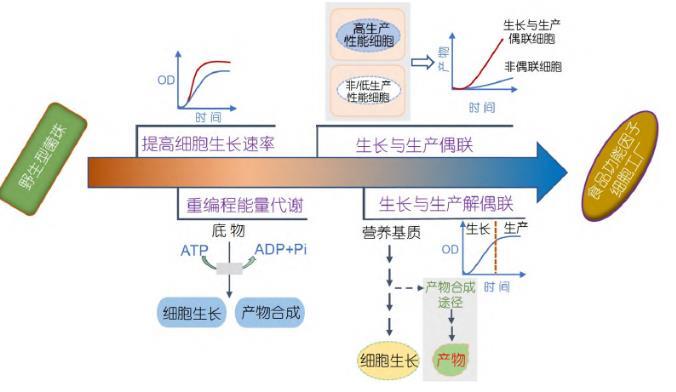
1優化底盤細胞生長速率
發酵過程中微生物有效吸收和代謝關鍵營養基質的能力直接影響細胞的生長.因此,提高碳源利用率或擴大可利用碳源的范圍能夠優化底盤細胞的生長速率,增加細胞密度,從而實現食品功能因子的高效合成[13].
1.1碳源轉運蛋白工程
微生物可以利用多種碳源,它們對碳源的選擇主要取決于胞內相關碳源轉運蛋白的表達,因此高效表達碳源轉運蛋白是提高碳源利用率的一種直觀快速方法.研究較為廣泛的是S.cerevisiae[14~18]和E.coli[19~23]中的各種內源和外源糖類轉運蛋白.S.cere visiae對己糖特別是葡萄糖的轉運機制已被很好地表征,它通過內源的Hxt家族己糖轉運蛋白介導的轉運系統來利用己糖[18,24].目前,已鑒定出約20種編碼己糖轉運蛋白的Hxt基因,研究表明,通過調節一種或幾種轉運蛋白的表達可提高細胞對葡萄糖的攝取能力,以S.cerevisiae CEN.PK m850作為出發菌株,經過改造使其具備乳酸合成能力,乳酸的生產強度為0.77 g/(L h),后通過強化HTX1基因的表達,提高菌株對葡萄糖的消耗速率,使得乳酸生產強度達到(0.85±0.02)g/(L h)[25].考慮到發酵成本和環境保護等因素,越來越多的糖組分成為微生物可利用的替代碳源[26].在無特異性轉運蛋白存在時,添加非天然碳源會明顯減弱底盤細胞的生長速率.而Wang等人[27]通過引入低親和力的阿拉伯糖轉運蛋白araE基因,使得S.cere visiae在以蔗糖為碳源的培養基中高效合成白藜蘆醇,產量達2.3 mg/L.因此,研究人員可通過引入外源轉運蛋白或改造內源Hxt轉運蛋白,使得S.cerevisiae在以蔗糖、果糖或纖維二糖等非天然碳源為營養基質的條件下進行有效生長,從而賦予其高產果聚糖[28]、檸檬酸[29]等食品功能因子的能力.Bruschi等人[30]在不能以蔗糖為碳源的E.coli基因組上整合表達蔗糖利用基因表達盒,發現菌株以蔗糖為碳源和以葡萄糖為碳源時的生長速率一致,這為以蔗糖或含蔗糖的廉價原料為碳源有效合成產品提供了可能.一方面,通過調節轉運蛋白表達強度或繼續挖掘其他碳源轉運蛋白有利于提高碳源攝取率并擴大可利用碳源種類,從而改善底盤細胞的生長性能和生產潛力.另一方面,轉運蛋白可能受到轉錄因子及其效應物的調控[31,32].因此,深入了解其調控機制可為合成食品功能因子底盤細胞的改造提供理論依據.
1.2適應性實驗室進化
適應性實驗室進化(adaptive laboratory evolu tion,ALE)是一種在特定生長環境或選擇壓力下,通過長期培養篩選獲得具有某種更優特性菌株的技術.它無需深入了解細胞錯綜復雜的代謝網絡,只需根據目標表型設計選擇壓力來篩選獲得較優突變株,具有適用范圍廣、實用性強等優點[33~35].適應性實驗室進化已被廣泛用于優化微生物底盤細胞的生長表型,以改善菌株的生產性能[36~39].B.subtilis作為GRAS(generally recognized as safe)菌株,已廣泛用于高效合成多種功能性低聚糖[40,41]、功能性單糖[42]及蛋白質[43]等食品功能因子.Liu等人[44]將野生型B.subtilis 168在M9基本培養基中傳代超過1000代,進化菌株A40的比生長速率提升43.5%,乙偶姻和卵清蛋白生物合成分別提高54.5%和20%.多層次組學技術可用于闡明進化株的進化機制及其基因型和表型之間的關聯,后者可用于指導構建或優化高效合成目標產物的細胞工廠.LaCroix等人[45]對E.coli MG1655進行為期81天的進化后獲得一株生長速率提高1.6倍的菌株.全基因組測序發現,主要是pyrE/rph基因間隔區、全局轉錄基因rpoB和DNA結構基因hns/tdk間隔區發生突變,pyrE/rph突變與菌株的嘧啶生物合成相關.經轉錄組學分析,rpoB和hns/tdk突變導致與蛋白合成、葡萄糖轉運和糖酵解途徑相關基因的表達水平上調,增加中心碳代謝途徑的通量,從而提高底盤細胞的生長速率.研究表明,C.gluta micum在以葡萄糖為唯一碳源的基本培養基中經過1500代培養后,其生長速率提高了42%.經基因組測序和反向代謝工程發現,轉錄調控因子GntR1和RamA的突變導致菌株生長性能的改善[46].因此,適應性實驗室進化結合組學分析可鑒定出提高底盤細胞生長適應性的關鍵突變點,有助于實現食品功能因子的高效生物合成.
適應性實驗室進化也可被用于優化微生物對碳源的攝取率,或者擴大微生物對替代碳源,如木糖、乙酸鹽和檸檬酸鹽等的利用范圍以提高細胞生長速率[34,47].木糖作為木質纖維素中含量第二豐富的糖類,如何高效轉化為功能營養品等高附加值產品是研究熱點.Promdonkoy等人[48]在以木糖作為唯一碳源的培養基中對S.cerevisiae進行適應性實驗室進化,提高了其對木糖的攝取能力,并鑒定出一株生長速率提高58%且異丁醇產量提升110%的菌株.Seong等人[49]以E.coli DSM01作為出發菌株,在以乙酸鈉為唯一碳源的M9培養基中傳代培養4 0天后獲得一株生長速率為0.14 h?1的進化株,而DSM01在該培養條件下幾乎無法生長.隨后驗證該進化菌株合成萜類化合物中間體甲羥戊酸(mevalonate,MVA)的能力,MVA的生產強度達到1.32 g/(L h),相比出發菌株提高14.3倍,這加速了乙酸鹽作為碳源生產功能營養品、生物燃料和重組蛋白等的研究進展.適應性實驗室進化也可用于實現微生物對混合碳源的吸收利用.例如,Reider Apel等人[16]對引入木糖利用途徑的S.cerevisiae BY4742菌株以木糖為碳源進行培養進化,進化后菌株經全基因組測序,發現己糖轉運蛋白HXT7(F79S)發生突變,該突變一方面提高了S.cerevisiae在以木糖為唯一碳源時對木糖的攝取率,從而展現出顯著的生長;另一方面,在存在雙碳源——葡萄糖和木糖時顯示出可同時利用兩種碳源的優良特性,從而減少培養時間并提高生產效率.由此可見,適應性實驗室進化可以有效提高微生物對不同底物的利用率和對環境的適應性,進化得到的高生長速率底盤細胞在改善產物合成方面具有很好的潛力(表1).
適應性實驗室進化與合成生物學和系統生物學工具相結合是一種優化菌株表型和性能的有效策略,刪除有害突變、保留有益突變可重構性能優異的微生物底盤細胞.適應性實驗室進化通過非直觀的方式提高微生物的適應性,但是由于突變本身很難達到精準預測,同時較長的進化周期可能導致錯失獲得最優表型的突變株.而基因組規模代謝模型[62~64]可揭示表型與基因型的相關性并用于預測生理變化,兩者相互結合補充可以更好地用于優化菌株表型或開發新的微生物平臺.
